Izotopo
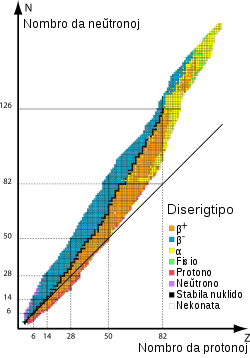 Tabelo de la izotopoj laŭ diserigtipo, kreita laŭ datumoj de programo Nucleus |  Grafiko de la atomaj izotopoj kolorigitaj laŭ duoniĝa tempo |
 Diagramo de ekzisto de izotopoj. Vertikale estas atommaso, pligrandiĝanta de supro suben. Horizontale estas diferenco de kvantoj de neŭtronoj kaj protonoj, je pli dekstre des pli multaj estas neŭtronoj. Ju pli malhela estas la bildo des pli ofta kaj stabila estas la izotopo. |
Nomiĝas izotopoj tiuj specoj de atomoj de la sama kemia elemento, kiuj havas malsamajn masojn. La elementoj en la naturo ĝenerale estas miksaĵoj de du aŭ pli izotopoj. La atomnumero, kiu indikas la nombron da protonoj estas la sama por du izotopoj, sed la nombro de neŭtronoj malsamas.
La nomo devenas el la grekaj isos, sama, kaj topos, loko, ĉar ili havas la saman lokon en la perioda tabelo de la elementoj.
Ĉar la atomnumero (aŭ atomnombro), Z, estas la sama, la ĥemiaj ecoj de du izotopoj estas la samaj. Tamen, la fizikaj ecoj povas tre malsimili.
En la scienca nomigado, la izotopojn oni alnomas per la nomo de la responda elemento, sekvata de la masnumero, kiu estas la nombro da nukleonoj (protonoj plus neŭtronoj), kaj kiu tre similas la atommason. La du partoj estas ĝenerale disigitaj per streketo. Kelkaj izotopoj posedas proprajn nomojn. Ekzemploj de konataj izotopoj: hidrogeno-3 aŭ tricio, karbono-12, karbono-14, uranio-238, ktp. En simbola formo la nombro da nukleonoj estas aldonita kiel superindekso al la kemia simbolo: 3H, 12C, 14C, 238U.
En la komuna lingvo estas ofte uzi la vorton izotopo por aludi la specon karakterizatan per difinitaj valoroj de Z kaj A. Striktasence, tia speco devus esti nomata nuklido, kaj oni devus alnomi izotopo la nuklidojn apartenantajn al la sama elemento. Tiel, la nuklidoj karbono-12 kaj karbono-14 estas ambaŭ izotopoj de la elemento karbono. Ili apenaŭ diferenciĝas el ĥemia vidpunkto, sed diferencoj en aliaj proprecoj povas taŭgi por multaj esploroj, kiel la radiokarbona datado.
Se la proporcio inter la kvantoj de protonoj kaj neŭtronoj ne estas la ĝusta por atingi la nuklean stabilecon, la izotopo estas radioaktiva.
La atompezo de elemento estas la averaĝo de la pezoj de la izotopoj trovitaj en la naturo.
Vidu ankaŭ |
- Listo de partikloj
- Radioaktiveco
- Duoniĝtempo
- Nuklea izomero
- Sammasnumera izotopo