Arsenata acido
Arsenata acido | ||
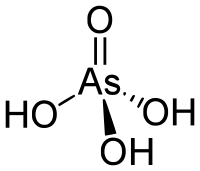 | ||
Plata kemia strukturo de la Arsenata acido | ||
 | ||
Tridimensia kemia strukturo de la Arsenata acido | ||
Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | H3AsO4 | |
| CAS-numero-kodo | 7778-39-4 | |
| ChemSpider kodo | 229 | |
| PubChem-kodo | 234 | |
| Merck Index | 15,785 | |
Fizikaj proprecoj | ||
| Aspekto | senkolora aŭ blanka nebrulema likvaĵo | |
| Molmaso | 141942 g·mol-1 | |
| Denseco | 2.2g cm−3 | |
| Fandpunkto | -35.5 °C | |
| Bolpunkto | 120 °C (malkomponiĝas) | |
| Acideco (pKa) | 2.22 | |
| Solvebleco | Akvo:167 g/L | |
| Mortiga dozo (LD50) | 48 mg/kg (buŝe) | |
Sekurecaj Indikoj | ||
| Riskoj | R23/25 | |
| Sekureco | S45 S53 | |
Pridanĝeraj indikoj | ||
Danĝero
| ||
| GHS Damaĝo Piktogramo | ||
| GHS Signalvorto | ||
| GHS Deklaroj pri damaĝoj | H301, H312, H314, H318, H331, H350, H361, H400, H410 | |
| GHS Deklaroj pri antaŭgardoj | P201, P202, P260, P261, P264, P270, P271, P273, P280, P281, P301+310, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P308+313, P310, P311, P312, P321, P330, P363, P391, P403+233, P405, P501[1] | |
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo (25 °C kaj 100 kPa) | ||
Arsenata acido estas kemia kombinaĵo konsistanta je unu atomo de arseno, kvar atomoj je oksigeno kaj tri hidrogenatomoj. Ĝi estas senkolora substanco kaj analogaĵo de la fosfata acido, kies saloj kondutas sin tre simile. Arsenata acido ne povas esti izolita sed trovata nur en akva solvaĵo kie ĝi larĝe joniziĝas.
Kristalspecimenoj de arsenata acido senhidratiĝas kiam temperaturo altas pli ol 100 °C. Komercaj aplikadoj de arsenata acido estas limigitaj pro ĝia tokseco. Ĝi estas antaŭaĵo de vasta gamo da pesticidoj, pro tio ĝi estas uzata ankaŭ kiel ligno-konservaĵo, biocido kaj reakcianto en la sintezo de tinkturoj en organikaj arsenaj komponaĵoj.
Enhavo
1 Sintezoj
1.1 Sintezo 1
1.2 Sintezo 2
1.3 Sintezo 3
1.4 Sintezo 4
2 Reakcioj
2.1 Reakcio 1
2.2 Reakcio 2
3 Literaturo
4 Referencoj
Sintezoj |
Sintezo 1 |
- Tiam kiam la akva solvaĵo estas abunde koncentrita, arsenata acido precipitiĝas tiel kiel etaj, senkoloraj, delikvaj kristaloj. Ĝi estas preparebla per interagado de la arsenata kvinoksido en akva solvaĵo en ĉeesto de nitrata acido:[2]
3As2O3+4HNO3+7H2O→6H3AsO4+4NO{displaystyle {3,As_{2}O_{3}+4,HNO_{3}+7,H_{2}O{xrightarrow {}}6,H_{3}AsO_{4}+4,NO}} |
Sintezo 2 |
- Se la solvaĵo estas malpli diluita, N2O3 estiĝas anstataŭ NO.
3As2O3+2HNO3+2H2O→2H3AsO4+N2O3{displaystyle {3,As_{2}O_{3}+2,HNO_{3}+2,H_{2}O{xrightarrow {}}2,H_{3}AsO_{4}+N_{2}O_{3}}} |
Sintezo 3 |
- Arsenata acido ankaŭ prepariĝas rekte elde la elementa arseno, ozono en akva solvaĵo:
2As+3H2O+5O3→2H3AsO4+5O2{displaystyle {2,As+3,H_{2}O+5,O_{3}{xrightarrow {}}2,H_{3}AsO_{4}+5,O_{2}}} |
Sintezo 4 |
- Arsenata acido povas sinteziĝi per reakcio inter duarsena trioksido, akvo kaj jodo:
As2O3+5H2O+2I2→2H3AsO4+4HI{displaystyle {As_{2}O_{3}+5,H_{2}O+2,I_{2}{xrightarrow {}}2,H_{3}AsO_{4}+4,HI}} |
Reakcioj |
Reakcio 1 |
- Arsenata acido malkomponiĝas ĉe altaj temperaturoj:
2H3AsO4→120oC2As2O5+3H2O{displaystyle {2,H_{3}AsO_{4}{xrightarrow {120^{o}C}}2,As_{2}O_{5}+3,H_{2}O}} |
Reakcio 2 |
- Arsenata acido posedas oksidigajn proprecojn, kiu manifestiĝas nur en acida medio:
H3AsO4+2HIjodidaacido⟶H3AsO3arsenitaacido+I2+H2O{displaystyle {mathsf {H_{3}AsO_{4}+{underset {jodida,acido}{2,HI}}longrightarrow {underset {arsenita,acido}{H_{3}AsO_{3}}}+I_{2}+H_{2}O}}} |
Literaturo |
- Chemicalland21
- ChemNet
- Lewis' Dictionary of Toxicology
- Implementation of Arsenic Treatment Systems
- Wiley Guide to Chemical Incompatibilities
Referencoj |
↑ Pubchem
↑ Inorganic Chemistry






