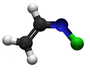
Vinila klorido
Vinila klorido | ||||
 | ||||
Plata kemia strukturo de la Vinila klorido | ||||
 | ||||
Tridimensia kemia strukturo de la Vinila klorido | ||||
Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | C2H3Cl | |||
| CAS-numero-kodo | 75-01-4 | |||
| ChemSpider kodo | 6098 | |||
| PubChem-kodo | 6338 | |||
| Merck Index | 15,10191 | |||
Fizikaj proprecoj | ||||
| Aspekto | senkolora, brulema gaso kun agrabla dolĉeca odoro | |||
| Moluma maso | 62,496 g·mol-1 | |||
| Denseco | 0,9106g cm−3 | |||
| Fandpunkto | -153,8°C | |||
| Bolpunkto | -13,4°C | |||
| Refrakta indico | n76120{displaystyle n_{761}^{20}} 1,3700 | |||
| Ekflama temperaturo | -78 °C | |||
| Solvebleco | Akvo:2,7 g/L | |||
| Mortiga dozo (LD50) | 500 mg/kg (buŝe) | |||
Sekurecaj Indikoj | ||||
| Riskoj | R12 R45 | |||
| Sekureco | S45 S53 | |||
Pridanĝeraj indikoj | ||||
Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa | |||
| GHS Deklaroj pri damaĝoj | H220, H280, H341, H350, H412 | |||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P273, P281, P308+313, P377, P381, P403, P405, P410+403, P501[1] | |||
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo (25 °C kaj 100 kPa) | ||||
Vinila klorido aŭ C2H3Cl estas organoklorhava kombinaĵo, ankaŭ konata kiel la unu-mero de la polivinila klorido aŭ kloroeteno, senkolora, brulema, toksa, karcinomogena gaso kun agrabla dolĉeca odoro, solvebla en akvo kaj tre uzata en la tuta mondo. En la atmosfero, ĝi estas liberigita de la kemiaj industrioj kaj formiĝas per disrompo de aliaj kloraj solvantoj. Ĝi estas polucianto de la atmosfero kaj eble estas malpurigaĵo de la akvo-provizejoj.
Klorido de vinilo estas stabila substanco en normalaj kondiĉoj, tamen ĝi malkomponiĝas sub altaj temperaturoj. Ĝi trovatas en la likva formo kiam konservata sub altaj premoj aŭ malaltaj temperaturoj. Vinila klorido posedas mildan dolĉecan odoron, kiu estas perceptebla sub koncentriĝoj je 3000 ppm en la atmosfero. Tamen, la odoro estas nenio rilate al preventado kontraŭ troa ekspozicio.
Multaj personoj ekgustas vinilan kloridon en la trinkakvo ĉe koncentriĝo je 3,4 ppm. Likva vinila klorido rapide vaporiĝas. Vinila klorido en akvo aŭ sursojle facile vaporiĝas se ĝi estas ĉe la surfaco. En la aero ĝi malkomponiĝas en la daŭro de kelkaj tagoj, rezultante en formado de sennombraj aliaj kemiaĵoj inklude de klorida acido, formaldehido kaj karbona duoksido.
Enhavo
1 Historio
2 Sintezoj
2.1 Sintezo 1
2.2 Sintezo 2
2.3 Sintezo 3
2.4 Sintezo 4
2.5 Sintezo 5
3 Reakcioj
3.1 Reakcio 1
3.2 Reakcio 2
3.3 Reakcio 3
3.4 Reakcio 4
3.5 Reakcio 5
3.6 Reakcio 6
4 Literaturo
5 Vidu ankaŭ
6 Referencoj
Historio |
Vinila klorido estis unue produktita en 1835 de la germana kemiisto Justus von Liebig (1803-1873) kaj lia franca lernanto Henri Victor Regnault (1810-1878). Ili estigis vinilan kloridon per traktado de 1,2-dukloroetileno kun solvaĵo de kalia hidroksido en etanola medio.
En 1912, la germana kemiisto Fritz Klatte (1880-1934), kiu tiam laboradis por kompanio Griesheim-Elektron, patentis manieron produkti vinilan kloridon ekde la acetileno kaj klorida acido uzante hidrargan kloridon kiel katalizilon. Kvankam ĉi-procezo estis vaste uzata dum la jardekoj 1930 kaj 1940 en la Okcidento, ĝi estis anstataŭita per pli malaltkostaj procezoj surbaze de la etileno en Usono kaj Eŭropo. Ĝi konserviĝas kiel la ĉefa produktado en Ĉinio.
Sintezoj |
Sintezo 1 |
- Preparado per traktado de 1,1-dukloroetileno kaj kalia hidroksido en alkohola medio:
|
Sintezo 2 |
- Preparado per interagado de la etileno kaj kloro:[2] Procedoj surbaze de acetileno estis disvolvitaj en la jardeko 1930 kaj estas pli koncizaj, tamen pro tio ke acetileno estas pli altkosta ol etleno, ĉi-procedoj estas uzataj multe malpli ol surbaze de etileno
|
Sintezo 3 |
- Preparado per reakcio inter vinila alkoholo kaj kloro:
|
Sintezo 4 |
- Preparado per malkomponado de la 1,2-dukloroetano sub alta temperaturo je 500 °C-600 °C sub premo:
|
Sintezo 5 |
- Preparado per traktado de 1,2-dukloroetileno kaj kalia hidroksido en alkohola medio:
|
Reakcioj |
Reakcio 1 |
- Preparado de 1,1-dufenila etano en ĉeesto de aluminia klorido:
2 |
Reakcio 2 |
- Preparado de vinila acetato kun natria acetato:
|
Reakcio 3 |
- Preparado de dumetilamino en ĉeesto de natria hidrarga amalgamo:
|
Reakcio 4 |
- Preparado de la Reakciaĵo de Grignard:
|
Reakcio 5 |
- Preparado de la vinil-tiofeno:
|
Reakcio 6 |
- Polimerizo de la vinila klorido:
|
Literaturo |
- Agency for Toxic Substances & Disease Registry
- National Cancer Institute
- Encyclopaedia Britannica
- InChem
- Dynamic behavior of vinyl chloride in aquatic ecosystems
- Genomic Adaptation for Organohalide Respiration of Vinyl Chloride and Other priority pollutants by the anaerobic bacterium dehalococcoides
- Plastics Materials
Vidu ankaŭ |
- Metil vinil etero
- Etil vinil etero
- Vinilbenzeno
- Vinila cinamato
- Vinila benzoato
- Vinila acetato
- Vinila formiato
- Vinila propionato
Referencoj |
↑ PubChem
↑ Vinyl Chloride Production from Ethylene and Chlorine






![{displaystyle {mathsf {{xrightarrow[{,}]{}},}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)
 +
+![{displaystyle {mathsf {{xrightarrow[{500^{o}C-600^{o}C}]{varmo}},}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/524c45eb052ace7689c23b8b89438ccf18b2cafa)
 +
+ +
+