Formaldehido
Formaldehido | |||||
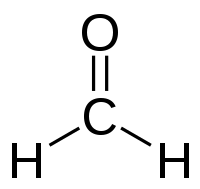 | |||||
Plata kemia strukturo de la Formaldehido | |||||
 | |||||
Tridimensia kemia strukturo de la Formaldehido | |||||
Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | CH2O | ||||
| CAS-numero-kodo | 50-00-0 | ||||
| ChemSpider kodo | 692 | ||||
| PubChem-kodo | 712 | ||||
| Merck Index | 15,4263 | ||||
Fizikaj proprecoj | |||||
| Aspekto | senkolora gaso | ||||
| Molmaso | 30.026 g·mol-1 | ||||
| Denseco | 0.8153g cm−3 | ||||
| Fandpunkto | -92 °C | ||||
| Bolpunkto | -19 °C | ||||
| Refrakta indico | n76120{displaystyle n_{761}^{20}} 1,3775[1] | ||||
| Ekflama temperaturo | 62 °C[2] | ||||
| Memsparka temperaturo | 300 °C | ||||
| Acideco (pKa) | 13.27 | ||||
| Solvebleco | Akvo:Tute solvebla | ||||
| Mortiga dozo (LD50) | 135 mg/kg (buŝe) | ||||
Sekurecaj Indikoj | |||||
| Riskoj | R45 R23/24/25 R39/23/24/25 R34 R68 R43 | ||||
| Sekureco | S53 S26 S36/37/39 S45 | ||||
Pridanĝeraj indikoj | |||||
Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa | ||||
| GHS Deklaroj pri damaĝoj | H228, H302, H312, H315, H317, H318, H319, H332, H334, H335, H351 | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P240, P241, P261, P264, P270, P271, P272, P280, P301+312, P302+352, P304+312, P304+340, P304+341, P305+351+338, P308+313, P310, P312, P321, P330, P332+313, P333+313, P337+313, P342+311, P362, P363, P370+378, P403+233[3] | ||||
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo (25 °C kaj 100 kPa) | |||||
Formaldehido[4][5] aŭ metanalo[6][7][5] (HCHO) estas organika kemia kombinaĵo, la plej simpla aldehido. La pura formaldehido estas senkolora, flamema, pikodora gaso, kiu iritas la mukomembranon.
Oni uzas en diversaj kemiindustriaj procesoj grandkvantan formaldehidon. Oni produktas ĝin ĉefe per vaporfaza oksidado de metanolo. Oni surmerkatigas ĝin plej ofte kiel formalinon (en akvo-solvaĵo de koncentreco de 37%). La formalino povas transformiĝi - per akvoperdo - al kristala trimero, trioksano aŭ amorfa polimero, paraformaldehido. La paraformaldehido tre konvenas pro produkti la gas-statan formaldehidon.
La reago de formaldehido kaj amonio estigas heksametilen-tetraminon, kiun oni uzas kiel ureteran antisepsaĵon. Per nitratigo de la heksametilen-tetramino estiĝas la eksplodaĵo heksogeno (alinome ciklonito aŭ RDX). La formaldehido kaj la acetaldehido transformiĝas - kun ĉeesto de kalcia hidroksido - al pentaeritrito, kies tetranitrato estas la ekplodaĵo PETN.
Oni uzas grandan kvanton da formaldehido por produktado de karbamidrezinoj, fenoplastoj kaj acetalrezinoj.
La formaldehido bone reagas kun proteinoj, tiel ĝi estas grava tanaĵo, desinfektaĵo, balsamaĵo.
En junio 2004 internacia laborgrupo de fakuloj decidis surbaze de ekzistaj epidemiologiaj studoj meti formaldehidon en grupo I, do karcinomiga (kancerkaŭza) por homoj (IARC, 2005).
Referencoj |
↑ Chemical Book
↑ Merck Millipore
↑ Pubchem
↑ (2002) NPIV, p. 356.
- ↑ 5,05,1PORTMANN, Doug; ROGERS, Donald. (1993) Kemia kaj scienc-teknika vortaro, p. 41, 82.
↑ Metanalo en vortaro.net
↑ Kemiaj afiksoj en la Esperanto-centro laŭ Jan Pióro, Kemiaj Afiksoj, Warszawa, 1966.






