Hidrogena cianido
Cianida acido | |||||
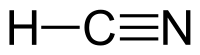 | |||||
Plata kemia strukturo de la Cianida acido | |||||
 | |||||
Tridimensia kemia strukturo de la Cianida acido | |||||
| Kemia formulo | HCN | ||||
| CAS-numero-kodo | 74-90-8 | ||||
| ChemSpider kodo | 748 | ||||
| PubChem-kodo | 768 | ||||
| Merck Index | 15,4832 | ||||
Fizikaj proprecoj | |||||
| Aspekto | senkolora, palflava aŭ blueca gaso | ||||
| Molmaso | 27.0253 g·mol-1 | ||||
| Denseco | 0.687g cm−3 | ||||
| Fandpunkto | -13 °C | ||||
| Bolpunkto | 26 °C | ||||
| Refrakta indico | n76120{displaystyle n_{761}^{20}} 1,2675 | ||||
| Ekflama temperaturo | -17.8 °C | ||||
| Memsparka temperaturo | 538 °C | ||||
| Acideco (pKa) | 9.21 | ||||
| Solvebleco | Akvo:Solvebla | ||||
| Mortiga dozo (LD50) | 160 mg/kg (buŝe) | ||||
Sekurecaj Indikoj | |||||
| Riskoj | R12 R26 R50/53 R26/27/28 [1] | ||||
| Sekureco | S7/9 S16 S36/37 S38 S45 S60 S61 | ||||
Pridanĝeraj indikoj | |||||
Danĝero
| |||||
GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H224, H300, H310, H330, H400, H410[2] | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P262, P264, P270, P271, P273, P280, P284, P301+310, P303+361+353, P304+340, P310, P320, P321, P330, P361, P363, P370+378, P391, P403+233, P403+235, P405, P501 | ||||
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo (25 °C kaj 100 kPa) | |||||
La acido hidrogena cianido aŭ cianida acido (kemia formulo: HCN) estas gaso, tre venena. Se oni enspiras eĉ malgrandan kvanton da hidrogena cianido, ĝi atencas la kemiajn procezojn de la sango, kiu portas la oksigenon en la korpo, kaj oni ne povas spiri. Tio povas kaŭzi rapidan morton.
Se oni laboras kun cianido (=salo de cianida acido), estas tre grave ne miksi ĝin kun acido.
Aparte la substanco natriocianido en kombino de acidaj substancoj facile disiĝas al la tre venena gaso hidrogena cianido:
- NaCN + H2SO4 → HCN + NaHSO4
Tiu paŝo povas esti konscia ago kadre de kemia militado, malpermesita fare de la ĝeneva konvencio de 1925, sed ankaŭ povas okazi akcidente, kiel ekzemple kadre de la katastrofaj eksplodoj de 2015 en Tjanĝino: Tie pro eksplodoj liberiĝis granda kvanto de natriocianido, kiu simple pro la acideco de la aera humideco, kaj ankoraŭ pli forte pro kontakto kun pluvo, transformiĝis al hidrogena acido, sen ke necesus pli fortaj acidoj.
Kombinaĵoj |
- Cianogena klorido
Vidu ankaŭ |
- Cianido
Referencoj |
↑ Chemical Book
↑ Pubchem







